Zadanie 11. (0–2)
W celu ustalenia składu stałej mieszaniny
wodorowęglanu sodu i
węglanu sodu jej próbkę rozpuszczono w wodzie i przeprowadzono dwuetapową analizę otrzymanego roztworu.
Etap I: Do badanego roztworu dodano kilka kropli alkoholowego roztworu fenoloftaleiny i dodawano z biurety kwas solny, do momentu zaniku barwy wskaźnika. Jon węglanowy jest mocniejszą zasadą niż jon wodorowęglanowy, więc w roztworze zachodziła reakcja opisana równaniem:
Odbarwienie fenoloftaleiny świadczyło o całkowitej przemianie jonów
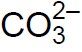
w jony
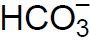 .
.
Etap II: Do otrzymanej mieszaniny dodano kilka kropli wodnego roztworu oranżu metylowego i dalej dodawano z biurety kwas solny do chwili, gdy nastąpiła zmiana barwy wskaźnika. Ta zmiana oznaczała, że cały wodorowęglan sodu przereagował zgodnie z równaniem:
Kwas solny użyty w obu etapach doświadczenia miał stężenie 0,2 mol · dm−3, a jego objętość niezbędna do odbarwienia fenoloftaleiny w etapie I była równa 24,6 cm3. Natomiast łącznie w obu etapach zużyto 59,8 cm3 kwasu solnego (objętość odczytana z biurety w etapie II).
Oblicz w procentach masowych zawartość węglanu sodu w analizowanej mieszaninie. Przyjmij, że masy molowe węglanu sodu i wodorowęglanu sodu są równe:
M Na2CO3 = 106 g ∙ mol–1 oraz M NaHCO3= 84 g ∙ mol–1 .
Obliczenia:
![]()




