Zadanie 12. (0–4)
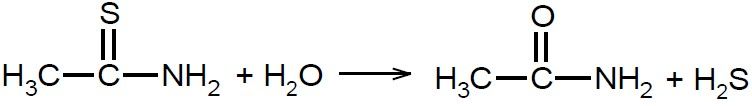
Tioacetamid w roztworze wodnym ulega hydrolizie z wydzieleniem siarkowodoru, więc jest stosowany do identyfikacji kationów metali, które tworzą trudnorozpuszczalne siarczki. Reakcję hydrolizy tioacetamidu opisuje równanie:
Minimalne stężenie kationów, przy którym zaczyna się strącać siarczek danego metalu, zależy od jego iloczynu rozpuszczalności oraz od pH roztworu. Wykres przedstawia zależność logarytmu z najmniejszego stężenia kationów Ni2+ (log c), przy którym następuje strącanie jego siarczku (NiS), od pH roztworu.
Na podstawie: J. Grau, M. Akine, J. Am. Ceram. Soc., 79 (1996) 1073,
oraz J. Minczewski, Z. Marczenko, Chemia analityczna, Warszawa 2012.
Przeprowadzono dwuetapowe doświadczenie. W pierwszym etapie, w zlewkach A i B, przygotowano oddzielnie dwa roztwory:
- do zlewki A, w której znajdował się kwas solny, w temperaturze T dodano pewną ilość tioacetamidu – po ustaleniu się stanu równowagi uzyskano 100 cm3 roztworu, którego pH było równe 2
- do zlewki B, w której znajdował się kwas solny, w temperaturze T dodano próbkę NiCl2 ∙ 6H2O o nieznanej masie i otrzymano 100 cm3 roztworu o pH równym 1,27.
W drugim etapie doświadczenia zmieszano zawartości obu zlewek i zaobserwowano, że w otrzymanej mieszaninie, której objętość była równa 200 cm3 , strącił się osad.
Oblicz minimalną masę NiCl2 ∙ 6H2O wyrażoną w miligramach, jakiej należało użyć do przygotowania roztworu w zlewce B. Wynik zaokrąglij do drugiego miejsca po przecinku. Przyjmij, że obecność słabego kwasu nie wpływa na pH roztworu oraz że MNiCl2 · 6H2O = 237, 7 g · mol–1

![]()





